图片来源:Pixabay
美国阿尔伯特·爱因斯坦医学院(Albert Einstein College of Medicine)的研究人员设计了一种实验性药物,它可以逆转小鼠阿尔茨海默病(Alzheimer's disease)的主要症状。该药物的工作原理是恢复细胞的清洁机制,通过消化和循环的方式来清除不需要的蛋白质。研究已于2021年4月22日在线发表在《细胞》(Cell)杂志上。
阿尔伯特·爱因斯坦医学院衰老研究所(the Institute for Aging Research)的联合主任、发育与分子生物学教授Ana Maria Cuervo是该研究的共同负责人,她对此介绍说:“以往,用小鼠做出的发现并不总能适用于人类,特别是在阿尔茨海默病的研究中。但我们此次的研究发现,细胞清洁能力的衰退是阿尔茨海默病的成因之一,这种现象不仅体现在小鼠身上,还发生在人类患者身上。这一发现让我们备受鼓舞,因为这表明该种药物或许对人类也同样有效。”20世纪90年代,Cuervo就发现了细胞清洁过程的存在,并将其称之为“分子伴侣介导的自噬”(chaperone-mediated autophagy,CMA),目前在健康和疾病领域已经发表了200余篇研究论文。

Ana Maria Cuervo 图片来源:Albert Einstein College of Medicine
随着人们年龄的增长,CMA的效率逐渐降低,不必要的蛋白质积聚成有损细胞的不溶性块状物的风险也在逐渐增加。事实上,患者大脑中存在有毒蛋白质的聚合物,是阿尔茨海默病和其他所有神经退行性疾病的共有特征。《细胞》上发表的论文揭示了CMA和阿尔茨海默病的动态相互作用:神经元中CMA的缺乏会导致阿尔茨海默病,反之亦然。研究结果表明,加速CMA的药物可能将为治疗神经退行性疾病带来希望。
建立CMA与阿尔茨海默病之间的联系
在此项研究中,Cuervo的团队首先研究了受损的CMA是否会导致阿尔茨海默病。为此,他们对一只小鼠进行了基因改造,使其大脑内的兴奋性神经元缺乏CMA。结果发现,仅一种类型的脑细胞缺失CMA就足以引起短期记忆丧失、行走障碍和其他一些在阿尔茨海默病的啮齿类动物模型中经常发现的问题。此外,在CMA缺失的情况下,蛋白质稳态(proteostasis)将被严重破坏,而这是细胞调节其所含蛋白质的能力。通常情况下,可溶性蛋白质会变为不可溶蛋白质,具有凝结成有毒聚合物的风险。
Cuerve对该现象的逆向怀疑也是正确的:早期的阿尔茨海默症也同样会损害CMA。她和同事们对一种相当于早期阿尔茨海默病的小鼠模型进行了研究,在这个模型中,小鼠的大脑神经元能产生tau蛋白的缺陷型拷贝。有证据表明,这种tau蛋白的异常拷贝会聚集在一起,形成神经原纤维缠结(neurofibrillary tangles),导致阿尔茨海默病产生。海马(hippocampus)是对于记忆和学习至关重要的大脑区域,研究团队重点研究了该区域神经元中的CMA活性,结果发现,与对照组的动物相比,患病小鼠神经元中的CMA活性显著降低。
那处于早期的阿尔茨海默病的人类患者呢?它是否也阻碍了(人类细胞的)CMA?为了找到答案,研究人员对阿尔茨海默病患者死后的大脑神经元进行了单细胞RNA测序,并与一组来自健康个体的对照组数据进行了比较,希望了解CMA在患者脑组织中的活动水平。果然,处于阿尔茨海默病早期阶段的患者,其CMA活性受到了一定程度的抑制;在阿尔茨海默症的晚期阶段,这种抑制情况更为严重。
Cuervo表示:“当人们到了70或80岁时,CMA活动水平通常会比他们年轻时减少约30%。虽然大多数人的大脑可以弥补这种衰退,但如果此时再加上神经退行性疾病,将对大脑神经元的正常蛋白质组成可能是毁灭性的影响。我们的研究表明,CMA功能缺陷与阿尔茨海默病的病理过程协同作用,这将大大加速疾病的发展。”
一种“清洁”神经元的新药
基于这一令人备受鼓舞的发现,Cuervo和团队开发了一种新药,这种药物显现出有效治疗阿尔茨海默病的潜力。Cuervo介绍说:“我们知道CMA能够消化有缺陷的tau蛋白和其他蛋白。但是阿尔茨海默病和其他神经退行性疾病中,大量的缺陷蛋白让CMA不堪重负、并导致其最终瘫痪。而我们的药物能够通过提高CMA关键成分的水平来重振CMA的效率。”
在CMA中,一种被称为分子伴侣(chaperones)的蛋白质会与机体细胞中受损或有缺陷的蛋白质结合,并将它们当作“货物”一般运输至细胞的溶酶体(lysosomes)。作为一种内部充满酶的膜结合型细胞器,溶酶体能起到消化和回收废物的作用。然而,为了能成功地将这些“货物”送入溶酶体,分子伴侣必须首先将它们“停靠”至称为LAMP2A的蛋白质受体“船坞”上,而这种受体就镶嵌在溶酶体的膜上。溶酶体上的LAMP2A受体越多,CMA活性就可能越高。这款被称为CA的新药,就是通过增加LAMP2A受体的数量来发挥作用的。
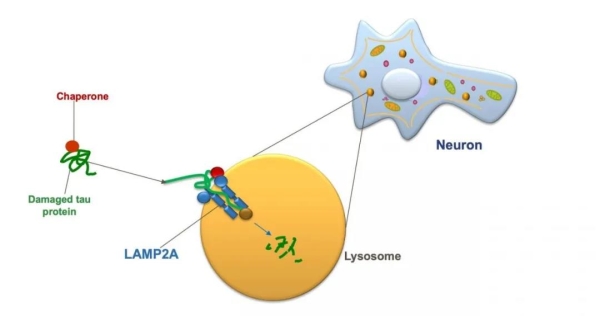
神经元内LAMP2A参与的细胞自噬。图片来源:Courtesy of Albert Einstein College of Medicine
Cuervo解释道:“人们一生中所产生的LAMP2A受体数量是相同的。但比起年龄的增加,这些受体的劣化速度更快。所以在老年人体内,将不需要的蛋白质输送到溶酶体的可用受体往往更少。CA这款药物能够将LAMP2A的数量恢复至年轻水平,使CMA能够有效摆脱tau蛋白和其他蛋白,这样,它们就不会形成那些有毒的蛋白质团块了。
同样在4月,Cuervo博士的团队在《自然-通讯》(Nature Communications)上报道称,他们首次从阿尔茨海默病患者的大脑中分离出了溶酶体,并观察到LAMP2受体数量的减少会导致人类CMA的丧失,就如同在动物模型中所发现的一样。
研究人员在两种不同的阿尔茨海默病小鼠模型中测试了CA,发现通过4到6个月的口服用药,这两种患病小鼠的记忆、抑郁和焦虑问题均得到改善,治疗后的小鼠与健康的对照组小鼠几乎没有差别。
Cuervo补充道:“重要的是,这两种模型中的动物都已显示出了疾病的症状,在给药前,它们的神经元就已经被有毒蛋白质堵塞了。这意味着这种药物甚至可以在疾病的后期帮助保持神经元的功能。另一件让我们感到兴奋的发现是,该药物还显著减少了胶质增生(gliosis)现象,即大脑神经元周围的炎症和瘢痕。胶质增生与毒性蛋白质有关,目前已知它在神经退行性疾病的持续和恶化中起着重要的作用。”
研究显示,即使长时间、每天服用CA,这种治疗方式也似乎并不会损害到其他器官。该药物是由生物化学和医学教授、研究的共同领导者Evripidis Gavathiotis博士设计的。
据悉,Cuervo和Gavathiotis已与马萨诸塞州波士顿(Boston,Mass)的Life Biosciences公司合作,建立了Selphagy Therapeutics公司。该公司目前正在开发CA和相关化合物,用于治疗阿尔茨海默病和其他神经退行性疾病。
翻译:许楚楚
编辑:魏潇
引进来源:Albert Einstein College of Medicine

本文来自:中国数字科技馆
特别声明:本文转载仅仅是出于科普传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或其它相关事宜,请与我们接洽。
[责任编辑:环球科学]

















 京公网安备11010502039775号
京公网安备11010502039775号





